 Казалось бы, простое химическое соединение – всего-то два атома водорода плюс один кислород. Появились молекулы воды в космических пылевых облаках еще до возникновения Солнечной системы. И по сути стали основой жизни на нашей планете. Впрочем, не только на нашей – это один из критериев ее поиска во Вселенной. Да что там говорить, мы сами на 55-65% состоим из сей жидкости.
Казалось бы, простое химическое соединение – всего-то два атома водорода плюс один кислород. Появились молекулы воды в космических пылевых облаках еще до возникновения Солнечной системы. И по сути стали основой жизни на нашей планете. Впрочем, не только на нашей – это один из критериев ее поиска во Вселенной. Да что там говорить, мы сами на 55-65% состоим из сей жидкости.
Посему так важны безопасность и качество той воды, которую пьем, используем для приготовления еды и в быту. Одним из значимых показателей здесь выступает жесткость. О ней слышал любой из нас, но что это по сути такое, чем она обусловлена, в каких значениях допустима, как в действительности сказывается на здоровье – осведомлены не все. Пришло время разобраться.
ВКРАТЦЕ, ЧТО ЖЕ МЫ ОБСУЖДАЕМ
О том, что вода бывает жесткой или мягкой вряд ли кто не в курсе. А вот почему так, объяснит далеко не каждый. Примеси упомянут все. Но какие именно и откуда они даже в набранной из родника? Тут самое время вспомнить, что вода на Земле постоянно путешествует – течет, просачивается, испаряется и т.д. И контактируя с горными породами растворяет и вымывает из них разные химические соединения, среди которых целый набор образованных кальцием, магнием и железом солей. Они так и именуются – соли жесткости.

Ее же бывает аж целых три вида. Общая – она равна сумме всех растворенных солей кальция и магния. И разделяется на временную и постоянную. Дело в том, что поведение солей отличается при нагревании. Так гидрокарбонаты разлагаются с образованием уже не растворимых карбонатов. Последние осаждаются в виде пресловутой накипи в чайнике. С этим связана временная или карбонатная жесткость.
Другим же кальциевым и магниевым солям (нитратам, хлоридам, сульфатам и т.д.) кипячение нипочем – они останутся растворенными. Такую жесткость именуют постоянной или некарбонатной. Измеряют сей параметр по количеству катионов (то есть заряженных положительно ионов) Ca2+ и Mg2+.

Ибо если вспомнить школьный учебник химии соли образуют катионы металлов, объединившиеся с анионами (ионами с отрицательным зарядом) кислотных остатков, по которым их и называют – карбонаты, хлориды, фосфаты, сульфаты и т.д. Когда соль (не только та, что пищевая) растворяется, то молекулы воды разделяют и окружают отдельные катионы и анионы, равномерно распределяя их по раствору.
Кстати, а откуда столь необычное название? Моющие средства пенятся и очищают за счет поверхностно-активных веществ (ПАВ). У традиционного мыла это натриевые соли стеариновой и пальмитиновой кислот. Так вот, при контакте с водой их натрий заменяется на Ca2+ и Mg2+, образуя малорастворимые соединения, поглощаемые тканью. Волокна утрачивают эластичность, становятся грубыми и тускнеют.

Утвержденные Международной системой единиц (SI) единицы измерения концентрации Ca2+ и Mg2+ – моли на метр кубический. На практике в ходу более скромные миллимоли на литр или кубический дециметр (ммоль/л или ммоль/дм3). Однако зачастую пользуются внесистемными единицами – градусами. Они бывают разными – немецкими, английскими, американскими и французскими.
Популярен американский градус, определяемый как 1 часть карбоната кальция (CaCO3) на 1 000 000 частей воды, что обычно соответствует одному миллиграмму на литр. Измеряется в ppm от parts per million (частей на миллион). Часто встречается немецкий градус общей жесткости dGH, который эквивалентен содержанию 10 мг оксида кальция (CaO) в одном литре. Есть еще миллиграмм-эквивалент на литр, когда один мг-экв/л означает присутствие в одном литре 20.04 мг катионов Ca2+.

Дабы не запутаться во всех этих размерностях окончательно, вот вам используемые Геологической службой США общие рекомендации по классификации (других пока нет). Вода с содержанием Ca2+ и Mg2+ считается:
- мягкой, если в ней <0.6 ммоль/л или <60 ppm (<3.37 dGH или <1.2 мг-экв/л);
- умеренно жесткой при 0.61÷1.2 ммоль/л или 61÷120 ppm (3.38÷6.74 dGH или 1.21÷2.4 мг-экв/л);
- жесткой, когда 1.21÷1.8 ммоль/л или 121÷180 ppm (6.75÷10.11 dGH или 2.41÷3.6 мг-экв/л);
- очень жесткой, если ≥1.81 ммоль/л или ≥181 ppm (≥10.12 dGH или ≥3.61 мг-экв/л).
ПЛОХА ЛИ ЖЕСТКАЯ ВОДА НА САМОМ ДЕЛЕ
Теперь перейдем к влиянию на здоровье. Итак, в каких пределах рассмотренные выше значения допустимо считать безопасными? А нет пока таковых! Ибо еще в 2011 году ВОЗ отметила, что для этого не имеется достаточно достоверно установленных данных. В природе абсолютно чистой воды никогда не существовало и всем организмам пришлось в той или иной мере приспосабливаться к наличию примесей.

К тому же нам с вами в сутки необходимо потреблять 300-350 мг магния и около 1 грамма кальция. Если в день вы употребите 2 литра жесткой воды, то получите с ней этих микроэлементов 5÷20% от нормы. В отчете американского Национального исследовательского совета (NRC) даже предложено считать такую жидкость пищевой кальциевой и магниевой добавкой.
Не имеется подтвержденного выраженного влияния ни на образование камней в почках, ни на возникновение сердечно-сосудистых заболеваний. Не выявлено и воздействия мягкой воды на баланс в организме микроэлементов. Чего не скажешь о дистиллированной, которая как раз и вымывает из клеток такие нужные им ионы. Особенно снижая в сыворотке крови до опасного уровня количество калия.

Заполучить гиперкальциемию от одной лишь жесткой воды тоже вряд ли получится. Лишние как кальций, так и магний выводятся почками и только нарушение их нормальной работы может вызвать проблемы со здоровьем. Да и особо много такой жидкости не выпьешь – она мутная из-за взвеси растворенных солей и с горьковатым привкусом.
Впрочем, определенные регламентирующие нормы все же есть. Так в Евросоюзе для питьевой воды принят показатель не более 1.2 ммоль/л. В ряде европейских стран постсоветского пространства для водопровода, бюветов и пунктов разлива – до 7 ммоль/л, а для скважин и колодцев допустимо до 10 ммоль/л.

Перейдем к так сказать классике жанра – воздействие на кожу и волосы. Широко бытует убеждение о разрушении жесткой водой защитной липидной пленки кожи, в результате возникает ощущение сухости, шелушение, зуд и даже появляется сыпь. А вот будто «мылкость» после купания в мягкой свидетельство того, что с липидной пленкой все нормально.
Наш эпидермис состоит из нескольких слоев. Из них защитным является внешний роговой. Его можно уподобить «стене» из «кирпичей» – клеток корнеоцитов (они же роговые чешуйки), скрепленных между собой «цементом» – жировыми ламелями (пресловутый липидный слой). Дополнительно усиливающей «арматурой» служат корнеодесмосомы.
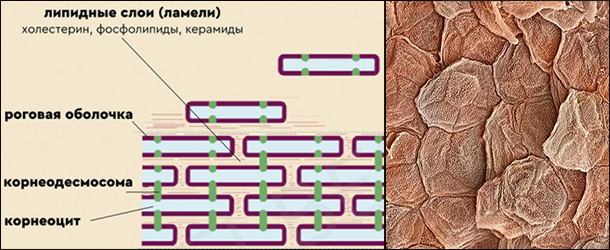
Когда целостность такого защитного барьера нарушается, то во внутренних слоях запускается процесс образования липидов и созревания новых корнеоцитов. Старая отмершая кожа отшелушивается, заменяясь новой. На сей процесс влияют разные факторы. И один из них – изменение концентрации (градиент) катионов Ca2+ в разных слоях эпидермиса. То есть попадающий на кожу извне Ca2+ порождает соответствующий отклик.
Однако для получения ощутимого эффекта требуется длительное время. В такой жидкости нужно жить, а не купаться. К тому же было установлено экспериментально, что оказывающийся на коже внешний кальций (как и магний) замедляет процесс восстановления рогового слоя и препятствует шелушению. Скорее всего сухость и раздражение вызваны воздействием ПАВ моющего средства или изменением рН кожи, но сие уже другая история.

Касательно волос, то сравнение между регулярно мытыми в дистиллированной и жесткой воде не выявило заметной разницы в их прочности и эластичности. Но волосы также имеют свойство адсорбировать (то бишь забирать из жидкости) катионы кальция и магния. Последние взаимодействуют с липидным слоем, оседая на поверхности в виде «накипи» и внедряясь в глубинную структуру. Причем итог будет разный для нормальных волос и модифицированных (окрашенных, выпрямленных, завитых и т.п.).
Воздействие жесткой воды на здоровые нормальные волосы мало ощутимо. А вот модифицированные активно поглощают кальций и магний, накапливая их до определенного предела насыщения. То есть постепенно минерализуются, превращаясь в шероховатую «наждачную бумагу». Фактически результат зависит от состояния самих волос.

В общем, умеренно насыщенная солями жесткости вода не наносит ущерба здоровому организму. Правда в ней хуже развариваются овощи и мясо. Ухудшается вкус чая. У кофе же, как гласит пресс-релиз Американского химического общества, вкус становится насыщеннее, поскольку во время заваривания кофеин связывается с магнием. От мыла и других моющих средств плохо образуется пена. На посуде остаются разводы и пятна белого налета, особенно неэстетичные на прозрачном стекле.
Однако по-настоящему проблемы соли жесткости создают для постоянно контактирующего с водой оборудования. Из-за них в трубах, на деталях сантехники, компонентах обогревательных котлов, элементах бытовой техники образуется накипь и известковые отложения. И приводит сие не только к поломкам. Поскольку у накипи низкая теплопроводность, то при ее появлении на теплообменниках бытовых устройств снижается интенсивность теплообмена. На нагрев приходится тратить больше энергии и перегреваются металлические поверхности.

Оценочное моделирование потерь показало, что если вы пользуетесь условно средними по энергопотреблению бойлером, стиральной и посудомоечной машиной, то из-за накипи всего в 3 мм перерасходуете за год 10 000 кВт·ч. В масштабе страны такие потери электроэнергии внушительны. И это без учета централизованных систем водо- и теплоснабжения. Причем вода в них и слишком мягкой не должна быть. Иначе снижается обеспечиваемая гидрокарбонатами кислотно-щелочная буферность и металлические детали ржавеют. Поэтому так важна правильная водоподготовка.

Если у вас есть подозрение насчет жесткости употребляемой воды, то проверить это совсем несложно. Правда не с лабораторной точностью, но она и не нужна. Самый простой способ – приобрести набор тест-полосок, у которых нанесенные на поверхность реагенты меняют цвет. Достаточно такую подержать в жидкости и сравнить с предоставленной шкалой. Или купить TDS-метр. Только учтите, что сей тестер показывает содержание в жидкости всех солей, а не только жесткости.